In इस लेख का पहला भाग, मैंने प्रक्रिया को स्पष्ट करने के लिए बायोएनटेक/फाइजर समझौतों का उपयोग करते हुए, अमेरिकी सरकार द्वारा कोविड एमआरएनए शॉट्स के प्रारंभिक विकास, निर्माण और अधिग्रहण के लिए लागू संविदात्मक और नियामक ढांचे की समीक्षा की।
मैंने दिखाया कि इन उत्पादों को नैदानिक परीक्षणों और विनिर्माण प्रक्रियाओं के आधार पर आपातकालीन उपयोग प्राधिकरण (ईयूए) प्रदान किया गया था
- कोई बाध्यकारी कानूनी मानक नहीं,
- कोई कानूनी रूप से निषिद्ध सुरक्षा निरीक्षण या विनियमन नहीं, और
- संभावित नुकसान के लिए निर्माता की ओर से कोई कानूनी निवारण नहीं।
इस अनुवर्ती लेख में, मैं अंतर्निहित दस्तावेज़ का विस्तृत विश्लेषण प्रदान करूंगा।
अन्य लेनदेन प्राधिकरण/समझौता (ओटीए): एक सैन्य अधिग्रहण मार्ग
RSI समझौता रक्षा विभाग (डीओडी) द्वारा प्रतिनिधित्व करने वाली अमेरिकी सरकार और बायोएनटेक/फाइजर साझेदारी का प्रतिनिधित्व करने वाली फाइजर के बीच जुलाई 2020 में "कोविड-19 को रोकने के लिए वैक्सीन" की खरीद एक सामान्य अधिग्रहण अनुबंध नहीं था।
यह अन्य लेनदेन प्राधिकरण (ओटीए) के तहत एक समझौता था - एक अधिग्रहण मार्ग, जिसके अनुसार रक्षा दिशा-निर्देशों का विभाग, का उपयोग 1958 से "एक संघीय एजेंसी को प्रवेश की अनुमति देने" के लिए किया जा रहा है अनुबंध, अनुदान, या सहकारी समझौतों के अलावा अन्य लेनदेन".
[बोल्डफेस जोड़ा गया]
DoD द्वारा OTA के उपयोग की संपूर्ण समीक्षा, इसके वैधानिक इतिहास सहित, में पाई जा सकती है 22 फरवरी, 2019 कांग्रेसनल रिसर्च सर्विस रिपोर्ट. यह रिपोर्ट, ओटीए की हर अन्य चर्चा के साथ, निर्दिष्ट करती है कि यह एक वैकल्पिक अधिग्रहण मार्ग है रक्षा और सैन्य उद्देश्यों के लिए. मुख्य रूप से नागरिक उपयोग के लिए इसका इरादा नहीं है, न ही इसका उपयोग कभी भी कोविड से पहले किया गया है।
अगर आप तलाश करेंगे यूएस कोड में ओटीए कानून, यह वह रास्ता है जिस पर आप चलेंगे:
सशस्त्र बल -> सामान्य सैन्य कानून -> अधिग्रहण -> अनुसंधान और इंजीनियरिंग -> समझौते -> कुछ प्रोटोटाइप परियोजनाओं को पूरा करने के लिए DoD का प्राधिकरण
यह कानूनी मार्ग बहुत स्पष्ट रूप से दिखाता है कि ओटीए कानून सशस्त्र बलों के लिए अनुसंधान और इंजीनियरिंग प्रोटोटाइप के अधिग्रहण के लिए हैं।
रक्षा विभाग के पास तीन अलग-अलग प्रकार के ओटी के लिए अधिकार हैं: (1) अनुसंधान ओटी, (2) प्रोटोटाइप ओटी, और (3) उत्पादन ओटी।
ये तीन प्रकार के ओटी प्रारंभिक अनुसंधान, प्रोटोटाइप के विकास और अंतिम उत्पादन के तीन चरणों का प्रतिनिधित्व करते हैं।
उन तीन प्रकारों के भीतर, परियोजनाओं की विशिष्ट श्रेणियां हैं जिन पर ओटीए आवेदन कर सकता है:
- मूल रूप से, के अनुसार ओटीए अवलोकन DoD द्वारा प्रदान किया गया, अन्य लेनदेन प्राधिकरण "DoD द्वारा अधिग्रहित या विकसित किए जाने वाले प्रस्तावित हथियारों या हथियार प्रणालियों पर लागू करने के लिए सीमित था।"
- ओटीए को बाद में "किसी भी प्रोटोटाइप परियोजना को शामिल करने के लिए विस्तारित किया गया था जो सीधे सैन्य कर्मियों के मिशन प्रभावशीलता को बढ़ाने और डीओडी द्वारा अधिग्रहित या विकसित किए जाने वाले सहायक प्लेटफार्मों, सिस्टम, घटकों या सामग्रियों, या प्लेटफार्मों, सिस्टम, घटकों के सुधार से संबंधित थी। , या सशस्त्र बलों द्वारा उपयोग में आने वाली सामग्री।"
अब तक, इनमें से कोई भी मुख्य रूप से नागरिक उपयोग के लिए लक्षित लाखों नवीन चिकित्सा उत्पादों के अधिग्रहण का मार्ग नहीं लगता है।
क्या ओटीए के नागरिक उपयोग के लिए कोई अपवाद है जो कोविड एमआरएनए टीकों पर लागू हो सकता है?
RSI वित्तीय वर्ष 2004 राष्ट्रीय रक्षा प्राधिकरण अधिनियम (पी.एल. 108-136) इसमें एक अनुभाग शामिल है जो अन्य लेनदेन प्राधिकरण को "एक कार्यकारी एजेंसी के प्रमुख को देता है जो बुनियादी अनुसंधान, अनुप्रयुक्त अनुसंधान, उन्नत अनुसंधान और विकास परियोजनाओं में संलग्न है" जिसमें "आतंकवाद या परमाणु, जैविक, से बचाव या पुनर्प्राप्ति की सुविधा प्रदान करने की क्षमता है।" रासायनिक या रेडियोलॉजिकल हमला।
यह प्रावधान 2018 तक बढ़ाया गया था, लेकिन ऐसा प्रतीत नहीं होता है कि इसे उस वर्ष से आगे बढ़ाया गया है। साथ ही, ध्यान दें कि ओटीए के गैर-डीओडी उपयोग के इस असाधारण मामले में भी, स्थिति में आतंकवाद या सामूहिक विनाश के हथियारों से हमला (सीबीआरएन) शामिल होना चाहिए.
अन्य कौन से ओटीए कानून लागू हो सकते हैं?
ऊपर उद्धृत 2019 सीआरएस रिपोर्ट यह चार्ट प्रदान करती है, जिसमें दिखाया गया है कि कुछ गैर-डीओडी एजेंसियों के पास कुछ ओटीए या संबंधित प्राधिकरण हैं:
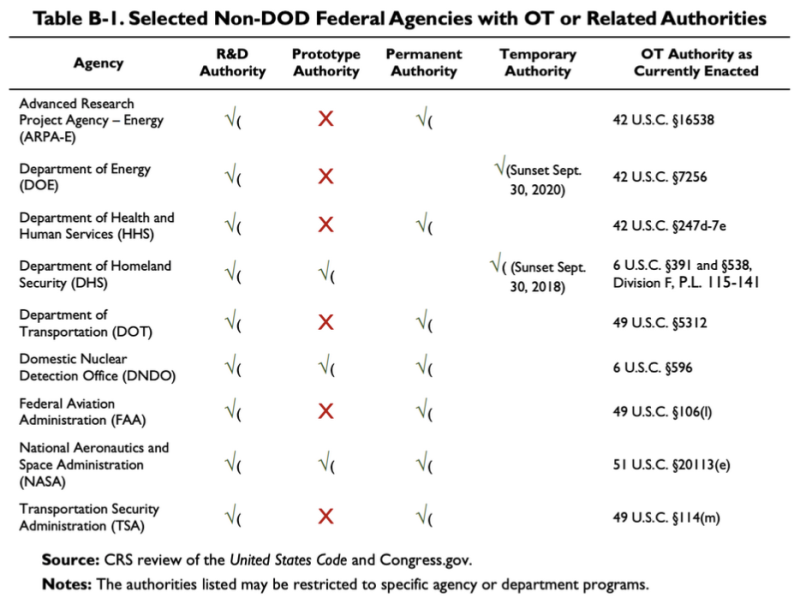
इस तालिका के अनुसार, स्वास्थ्य और मानव सेवा विभाग (HHS) के पास कुछ अनुसंधान और विकास (R&D) अन्य लेनदेन प्राधिकरण हैं। से संबंधित कानून एचएचएस का ओटी प्राधिकरण 42 यू.एस.सी. है। §247डी-7ई.
यह कानून कहाँ स्थित है और यह क्या कहता है?
सार्वजनिक स्वास्थ्य और कल्याण -> सार्वजनिक स्वास्थ्य सेवा -> सामान्य शक्तियां और कर्तव्य -> संघीय-राज्य सहयोग -> बायोमेडिकल एडवांस्ड रिसर्च एंड डेवलपमेंट अथॉरिटी (BARDA) -> लेनदेन प्राधिकरण
इसलिए नागरिक स्वास्थ्य और कल्याण से संबंधित कानून में एक जगह है जहां ओटीए लागू हो सकता है, हालांकि यह वैध है केवल अनुसंधान और विकास के लिए, प्रोटोटाइप या विनिर्माण के लिए नहीं।
कानून कहता है कि BARDA सचिव के पास OT प्राधिकरण है
किसी ऐसे उत्पाद के संबंध में जो है या बन सकता है योग्य प्रति उपाय या एक योग्य महामारी या महामारी उत्पाद, गतिविधियाँ जो मुख्य रूप से-
(i) उत्पाद के बुनियादी अनुसंधान और प्रीक्लिनिकल विकास के बाद आयोजित किए जाते हैं; और
(ii) व्यावसायिक पैमाने पर उत्पाद के निर्माण से संबंधित हैं और ऐसे रूप में जो संघीय के तहत नियामक आवश्यकताओं को पूरा करता हो खाद्य, औषधि और प्रसाधन सामग्री अधिनियम [21 यूएससी 301 et seq.] या इसके अंतर्गत इस शीर्षक की धारा 262.
[बोल्डफेस जोड़ा गया]
कानून में उल्लिखित "नियामक आवश्यकताओं" का मतलब है कि BARDA/HHS के लिए ऐसे किसी भी चिकित्सा उत्पाद (जैसे एमआरएनए टीके) के लिए, यहां तक कि सिर्फ अनुसंधान एवं विकास के लिए भी समझौते करना असंभव होगा, जो कठोर सुरक्षा परीक्षण और सख्त विनिर्माण निरीक्षण से नहीं गुजरा है।
DoD के साथ HHS "साझेदारी" ने नागरिक सुरक्षा कानूनों को दरकिनार कर दिया
सामान्य तौर पर नागरिक प्राधिकारियों और विशेष रूप से कोविड एमआरएनए टीकों के संबंध में अन्य लेनदेन प्राधिकरण/समझौतों की दुर्दशा को संक्षेप में प्रस्तुत करने के लिए:
- ओटीए को बहुत अधिक नौकरशाही लालफीताशाही के बिना सेना के लिए हथियार और अन्य आवश्यक प्रणालियाँ और उपकरण प्राप्त करने के एक तरीके के रूप में लिखा और संहिताबद्ध किया गया था। इसमें अनुसंधान और विकास, प्रोटोटाइप और उसके बाद के विनिर्माण को शामिल किया गया है।
- सार्वजनिक स्वास्थ्य एजेंसी के लिए एकमात्र ओटीए एचएचएस के लिए है और यह केवल अनुसंधान एवं विकास को कवर करता है, प्रोटोटाइप या विनिर्माण को नहीं।
- यहां तक कि एचएचएस को दिए गए आर एंड डी ओटीए को अभी भी दवा और वैक्सीन सुरक्षा के लिए उत्पादों को "ऐसे रूप में निर्मित करने की आवश्यकता है जो नियामक आवश्यकताओं को पूरा करता हो"।
दूसरे शब्दों में: ऐसा कोई तरीका नहीं है जिससे एचएचएस अपने बहुत ही सीमित ओटीए का उपयोग करोड़ों नवीन चिकित्सा उत्पादों के अनुबंध पर हस्ताक्षर करने के लिए कर सके।
तो एचएचएस ने क्या किया?
जैसा कि सरकारी जवाबदेही कार्यालय (जीएओ) ने अपने लेख में उल्लेख किया है "कोविड-2021 अनुबंध:" पर जुलाई 19 की रिपोर्ट एचएचएस ने "डीओडी के ओटीए प्राधिकारियों का लाभ उठाने के लिए डीओडी के साथ "साझेदारी" की...जिसमें एचएचएस की कमी थी।" (पी। 24)
चिकित्सा उत्पादों के लिए DoD के OT प्राधिकरण क्या हैं?
जैसा कि चर्चा की गई है, ओटीए का उद्देश्य सेना को बिना किसी नौकरशाही परेशानी के उपकरण और प्रौद्योगिकी प्राप्त करने में मदद करना है। ओटीए से संबंधित किसी भी मूल कानून में "सैन्य कर्मियों के मिशन की प्रभावशीलता को बढ़ाने" के उद्देश्य से "प्लेटफॉर्म, सिस्टम, घटकों या सामग्रियों" के अलावा किसी अन्य चीज़ का उल्लेख नहीं किया गया है।
लेकिन कोविड से पांच साल पहले, ओटीए का एक असाधारण उपयोग शुरू किया गया था:
2015 में, डीओडी ने घोषणा की सीबीआरएन मेडिकल काउंटरमेजर कंसोर्टियम की स्थापना, जिसका उद्देश्य ओटीए अधिग्रहण मार्ग का उपयोग "एफडीए लाइसेंस प्राप्त रासायनिक, जैविक, रेडियोलॉजिकल और परमाणु चिकित्सा काउंटरमेजर्स विकसित करने के लिए डीओडी के साथ काम करना" था। [एफडीए = खाद्य एवं औषधि प्रशासन]
जैसा कि 2015 की घोषणा में वर्णित है, इसमें "डीओडी के हित के वायरल, बैक्टीरियल और जैविक विष लक्ष्यों को लक्षित करने वाले चिकित्सीय चिकित्सा प्रतिवादों के लिए प्रोटोटाइप प्रौद्योगिकियां शामिल हैं।" एजेंटों की सूची में एंथ्रेक्स, इबोला और मारबर्ग जैसे शीर्ष जैवयुद्ध रोगजनक शामिल थे।
घोषणा में यह निर्दिष्ट किया गया है कि "सक्षम प्रौद्योगिकियों में वायरल, बैक्टीरियल या जैविक विष रोग और रोगजनन (जोखिम के कई मार्ग), परख, नैदानिक प्रौद्योगिकियां या अन्य प्लेटफ़ॉर्म प्रौद्योगिकियां शामिल हो सकती हैं जिन्हें अनुमोदित या लाइसेंस प्राप्त एमसीएम के विकास के लिए लागू किया जा सकता है। [चिकित्सा प्रतिउपाय]।"
हालाँकि यह अभी भी नागरिक उपयोग के लिए 100 मिलियन नवीन टीकों के उत्पादन जैसा कुछ नहीं लगता है, यह एचएचएस को दिए गए बहुत सीमित अन्य लेनदेन प्राधिकरण की तुलना में ओटीए के लिए अधिक छूट प्रदान करता है।
जबकि एचएचएस ओटीए को व्यापक विकास और विनिर्माण नियमों के पालन की आवश्यकता होती है, डीओडी के लिए मेडिकल काउंटरमेशर्स विकसित करने के लिए ओटीए मार्ग को केवल "एफडीए लाइसेंस" की आवश्यकता होती है।
इस प्रकार, डीओडी अन्य लेनदेन प्राधिकरणों का उपयोग करके, सैद्धांतिक रूप से किसी भी सुरक्षा नियमों को बायपास करना संभव होगा - जो ओटीए-जनरेटेड उत्पाद के एफडीए लाइसेंसिंग की आवश्यकताओं पर निर्भर करता है। जैसा कि हम देखेंगे, कोविड एमआरएनए टीकों के मामले में, आपातकालीन उपयोग प्राधिकरण प्रदान किया गया था, जिसके लिए किसी भी कानूनी सुरक्षा निरीक्षण की आवश्यकता नहीं थी।
आपातकालीन उपयोग प्राधिकरण (EUA)
खाद्य एवं औषधि प्रशासन इस प्रकार है (एफडीए) अपनी ईयूए शक्तियों का वर्णन करता है:
FD&C अधिनियम की धारा 564 (21 यू.एस.सी. 360बीबीबी-3) एफडीए को जैविक, रासायनिक, परमाणु और रेडियोलॉजिकल एजेंटों के खिलाफ सार्वजनिक स्वास्थ्य सुरक्षा को मजबूत करने की अनुमति देता है।
इस EUA प्राधिकरण के साथ, FDA यह सुनिश्चित करने में मदद कर सकता है कि जैविक, रासायनिक, परमाणु या रेडियोलॉजिकल एजेंटों के कारण होने वाली गंभीर या जीवन-घातक बीमारियों या स्थितियों के निदान, उपचार या रोकथाम के लिए आपातकालीन स्थितियों में चिकित्सा प्रति-उपायों का उपयोग किया जा सकता है, जब पर्याप्त, अनुमोदित नहीं होते हैं , और उपलब्ध विकल्प (अन्य मानदंडों के बीच)।
यह समझना बेहद महत्वपूर्ण है कि ये ईयूए शक्तियां 2004 में सामूहिक विनाश के हथियारों, जिन्हें सीबीआरएन (रासायनिक, जैविक, रेडियोलॉजिकल, परमाणु) एजेंटों के रूप में जाना जाता है, के हमलों की तैयारी से संबंधित बहुत विशिष्ट परिस्थितियों में प्रदान की गई थीं।
यथा व्याख्यायित हार्वर्ड लॉ के स्वास्थ्य विधेयक में,
अंततः, यह आतंक के विरुद्ध युद्ध ही था जो आपातकालीन उपयोग प्राधिकरण को जन्म देगा। 11 सितंबर 2001 की घटनाओं और उसके बाद एंथ्रेक्स मेल हमलों के बाद, कांग्रेस ने अधिनियम बनाया 2004 का प्रोजेक्ट बायोशील्ड अधिनियम. इस अधिनियम में बायोटेरर हमले की तैयारी के लिए टीकों की खरीद और आपातकालीन जवाबी उपायों के भंडारण के लिए अरबों डॉलर के विनियोजन की मांग की गई थी। किसी आपात स्थिति में तेजी से कार्य करने में सक्षम होने के लिए, कांग्रेस ने एफडीए को सार्वजनिक स्वास्थ्य और सुरक्षा के लिए खतरे के खिलाफ आपातकालीन उपयोग के लिए औपचारिक रूप से अस्वीकृत उत्पादों को अधिकृत करने की अनुमति दी (एचएचएस द्वारा आपातकाल की घोषणा के अधीन)। रिकॉर्ड इंगित करता है कि कांग्रेस का ध्यान विशेष रूप से जैव-आतंकवाद के खतरे पर था, न कि प्राकृतिक रूप से उत्पन्न होने वाली महामारी की तैयारी पर।
RSI EUA कानून की शब्दावली इस तथ्य को रेखांकित करता है कि इसका उद्देश्य सामूहिक विनाश के हथियारों से जुड़ी स्थितियों में उपयोग करना था। यहां वे 4 स्थितियाँ हैं जिनमें EUA जारी किया जा सकता है:
- होमलैंड सिक्योरिटी के सचिव द्वारा एक दृढ़ संकल्प कि घरेलू आपातकाल है, या घरेलू आपातकाल की एक महत्वपूर्ण संभावना है, जिसमें जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंटों के साथ हमले का खतरा बढ़ गया है;
- रक्षा सचिव द्वारा एक दृढ़ संकल्प कि एक सैन्य आपातकाल है, या सैन्य आपातकाल की एक महत्वपूर्ण संभावना है, जिसमें यूनाइटेड के लिए एक बढ़ा जोखिम शामिल है राज्य सैन्य बल, जिसमें हमले के शीर्षक 10 या शीर्षक 50 के अधिकार के तहत काम करने वाले कर्मी शामिल हैं-
- एक जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंट; या
- एक एजेंट या एजेंट जो युनाइटेड के लिए आसन्न जीवन-घातक और विशिष्ट जोखिम पैदा कर सकता है, या अन्यथा उससे जुड़ा हुआ है राज्य सैनिक बल;
- द्वारा एक संकल्प सचिव कि कोई सार्वजनिक स्वास्थ्य आपातकाल है, या सार्वजनिक स्वास्थ्य आपातकाल की एक महत्वपूर्ण संभावना है, जो राष्ट्रीय सुरक्षा या यूनाइटेड के स्वास्थ्य और सुरक्षा को प्रभावित करती है, या प्रभावित करने की महत्वपूर्ण क्षमता रखती है। राज्य विदेश में रहने वाले नागरिक, और इसमें कोई जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंट, या कोई बीमारी या स्थिति शामिल है जो ऐसे एजेंट या एजेंटों के लिए जिम्मेदार हो सकती है; या
- की धारा 319एफ-2 के अनुसार किसी भौतिक खतरे की पहचान सार्वजनिक स्वास्थ्य सेवा अधिनियम [42 यू.एस.सी. 247डी-6बी] राष्ट्रीय सुरक्षा या यूनाइटेड के स्वास्थ्य और सुरक्षा को प्रभावित करने के लिए पर्याप्त है राज्य विदेश में रहने वाले नागरिक.
इन चार स्थितियों में कहीं भी प्राकृतिक रूप से उत्पन्न होने वाली महामारी, महामारी या किसी अन्य प्रकार की सार्वजनिक स्वास्थ्य स्थिति का कोई उल्लेख नहीं है जो "जैविक, रासायनिक, रेडियोलॉजिकल या परमाणु एजेंटों" के कारण नहीं होती है।
क्या SARS-CoV-2 ऐसे एजेंट के रूप में योग्य हो सकता है?
यदि आप "की परिभाषा खोजते हैंजैविक एजेंटअमेरिकी कानूनी संहिता में, आप निम्नलिखित मार्ग पर चलेंगे:
अपराध और आपराधिक प्रक्रिया -> अपराध -> जैविक हथियार -> परिभाषाएँ
इसलिए संयुक्त राज्य अमेरिका के कानून के संदर्भ में, "जैविक एजेंट" शब्द का अर्थ जैविक हथियार है, और ऐसे एजेंटों/हथियारों का उपयोग अपराध माना जाता है।
विकिपीडिया यह प्रदान करता है परिभाषा:
एक जैविक एजेंट (जिसे बायो-एजेंट, जैविक खतरा एजेंट, जैविक युद्ध एजेंट, जैविक हथियार या बायोहथियार भी कहा जाता है) एक है जीवाणु, वाइरस, प्रोटोजोआ, परजीवी, कुकुरमुत्ता, या विष जिसका उपयोग जानबूझकर एक हथियार के रूप में किया जा सकता है bioterrorism or जैविक युद्ध (बीडब्ल्यू)।
कोविड एमआरएनए टीकों के लिए ईयूए किस कानूनी आधार पर जारी किया गया था?
ऐसा प्रतीत होता है, EUA से संबंधित कानूनों के आधार पर, कानून में वर्णित चार संभावित स्थितियों में से कोई भी प्राकृतिक रूप से उत्पन्न होने वाले रोगज़नक़ के कारण होने वाली बीमारी को रोकने या उसका इलाज करने के उद्देश्य से उत्पाद पर लागू नहीं किया जा सकता है।
फिर भी, इस कानून का उपयोग एमआरएनए कोविड टीकों को अधिकृत करने के लिए किया गया था।
ईयूए कानून में सूचीबद्ध चार विकल्पों को देखते हुए, वह विकल्प जिसका उपयोग कोविड के लिए "प्रतिउपाय" के लिए किया गया था
सी) द्वारा एक निर्धारण सचिव कि कोई सार्वजनिक स्वास्थ्य आपातकाल है, या सार्वजनिक स्वास्थ्य आपातकाल की एक महत्वपूर्ण संभावना है, जो राष्ट्रीय सुरक्षा या यूनाइटेड के स्वास्थ्य और सुरक्षा को प्रभावित करती है, या प्रभावित करने की महत्वपूर्ण क्षमता रखती है। राज्य विदेश में रहने वाले नागरिक, और इसमें एक जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंट, या एक बीमारी या स्थिति शामिल है जो ऐसे एजेंट या एजेंटों के लिए जिम्मेदार हो सकती है।
. विशेष रूप से कोविड पर लागू किया गया, इसे इस प्रकार कहा गया था:
स्वास्थ्य और मानव सेवा विभाग (एचएचएस) के सचिव ने निर्धारित किया कि एक सार्वजनिक स्वास्थ्य आपातकाल है जिसमें राष्ट्रीय सुरक्षा या विदेशों में रहने वाले संयुक्त राज्य के नागरिकों के स्वास्थ्य और सुरक्षा को प्रभावित करने की महत्वपूर्ण क्षमता है, और इसमें वह वायरस शामिल है जो कोरोनवायरस का कारण बनता है रोग 2019 (कोविड-19)…
इसमें कोई संदेह नहीं है कि "वायरस जो सीओवीआईडी -19 का कारण बनता है" को "जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंटों" के बराबर माना जाता है।
यह भी ध्यान रखना महत्वपूर्ण है कि EUA "सार्वजनिक स्वास्थ्य आपातकाल का निर्धारण" पूरी तरह से अलग है, और किसी भी अन्य सार्वजनिक स्वास्थ्य आपातकालीन घोषणाओं पर निर्भर नहीं है, जैसे कि WHO, अमेरिकी सरकार द्वारा की गई थी। , और कोविड-19 महामारी की शुरुआत में राष्ट्रपति।
इसलिए जब डब्ल्यूएचओ, अमेरिकी सरकार और राष्ट्रपति घोषणा करते हैं कि महामारी खत्म हो गई है, तब भी आपातकालीन उपयोग प्राधिकरण हो सकता है यदि एचएचएस सचिव यह दावा करना जारी रखते हैं कि खंड सी में वर्णित स्थिति मौजूद है।
को देखते हुए सैकड़ों कोविड-संबंधित चिकित्सा उत्पादों के लिए सभी ईयूए, यह देखना बहुत मुश्किल है कि एचएचएस सचिव इस दावे को कैसे उचित ठहरा सकते हैं कि "एक सार्वजनिक स्वास्थ्य आपातकाल है जिसमें राष्ट्रीय सुरक्षा या विदेश में रहने वाले अमेरिकी नागरिकों के स्वास्थ्य और सुरक्षा को प्रभावित करने की महत्वपूर्ण क्षमता है" यदि सभी नहीं, तो अधिकांश में। इन मामलों का.
आपातकालीन उपयोग प्राधिकरण प्रदान करने के लिए एफडीए के लिए अतिरिक्त "वैधानिक मानदंड"।
एक बार जब एचएचएस सचिव घोषणा करते हैं कि एक सार्वजनिक स्वास्थ्य आपातकाल है जो कानून में सूचीबद्ध चार स्थितियों में से एक के आधार पर ईयूए की गारंटी देता है, तो चार और "वैधानिक मानदंड" हैं जिन्हें ईयूए जारी करने के लिए एफडीए को पूरा करना होगा। . यहां बताया गया है कि FDA इन आवश्यकताओं को कैसे समझाता है:
- गंभीर या जीवन-घातक रोग या स्थिति
एफडीए द्वारा ईयूए जारी करने के लिए, एचएचएस सचिव की ईयूए घोषणा में उल्लिखित सीबीआरएन एजेंट गंभीर या जीवन-घातक बीमारी या स्थिति पैदा करने में सक्षम होना चाहिए।
नोट: यह मानदंड सीबीआरएन एजेंट के विनिर्देश को दोहराता है, जिसे कानूनी तौर पर अपराध करने में इस्तेमाल किए जाने वाले हथियार के रूप में परिभाषित किया गया है।
- प्रभावशीलता का प्रमाण
जिन चिकित्सा उत्पादों पर ईयूए के लिए विचार किया जा सकता है, वे वे हैं जो एचएचएस सचिव की घोषणा में पहचाने गए सीबीआरएन एजेंटों के कारण होने वाली गंभीर या जीवन-घातक बीमारियों या स्थितियों को रोकने, निदान या इलाज करने के लिए "प्रभावी" हो सकते हैं। धारा 564(बी) के तहत आपातकाल या आपातकाल का खतरा।
ईयूए के लिए "प्रभावी हो सकता है" मानक "प्रभावीता" मानक की तुलना में निम्न स्तर के साक्ष्य प्रदान करता है जिसे एफडीए उत्पाद अनुमोदन के लिए उपयोग करता है। एफडीए जोखिम-लाभ विश्लेषण का उपयोग करके मामले-दर-मामले आधार पर संभावित ईयूए उत्पाद की संभावित प्रभावशीलता का आकलन करने का इरादा रखता है, जैसा कि नीचे बताया गया है।
[बोल्डफेस जोड़ा गया]
कानूनी प्रश्न: कोई कानूनी तौर पर यह दावा कैसे कर सकता है कि ईयूए के तहत अधिकृत उत्पाद "सुरक्षित और प्रभावी" है यदि ईयूए के लिए कानूनी मानक "प्रभावी हो सकता है" और एफडीए घोषणा करता है कि यह इस्तेमाल किए गए मानक की तुलना में "निचले स्तर का साक्ष्य" है। नियमित उत्पाद अनुमोदन के लिए?
- जोखिम-लाभ विश्लेषण
किसी उत्पाद पर ईयूए के लिए विचार किया जा सकता है यदि आयुक्त यह निर्धारित करता है कि उत्पाद के ज्ञात और संभावित लाभ, जब पहचानी गई बीमारी या स्थिति के निदान, रोकथाम या उपचार के लिए उपयोग किए जाते हैं, तो उत्पाद के ज्ञात और संभावित जोखिमों से अधिक होते हैं।
यह निर्धारित करने में कि क्या उत्पाद के ज्ञात और संभावित लाभ ज्ञात और संभावित जोखिमों से अधिक हैं, एफ.डी.ए देखने का इरादा है समग्र जोखिम-लाभ निर्धारण करने के लिए वैज्ञानिक प्रमाणों की समग्रता पर। ऐसे सबूत, जो उत्पन्न हो सकता है विभिन्न स्रोतों से, हो सकता है कि शामिल हो (लेकिन यह यहीं तक सीमित नहीं है): घरेलू और विदेशी नैदानिक परीक्षणों के परिणाम, पशु मॉडल से इन विवो प्रभावकारिता डेटा, और इन विट्रो डेटा, एफडीए विचार के लिए उपलब्ध है. एफडीए इसकी गुणवत्ता और मात्रा का भी आकलन करेगा उपलब्ध साक्ष्य, वैज्ञानिक ज्ञान की वर्तमान स्थिति को देखते हुए।
[बोल्डफेस जोड़ा गया]
कानूनी नोट: कोई कानूनी मानक नहीं है और "ज्ञात और संभावित लाभों" का "ज्ञात और संभावित जोखिमों" से अधिक होने का क्या मतलब है, इसकी कोई कानूनी परिभाषा नहीं है। स्वीकार्य "उपलब्ध साक्ष्य" के लिए कोई गुणात्मक या मात्रात्मक कानूनी परिभाषा भी नहीं है, जिस पर जोखिम-लाभ विश्लेषण "आधारित" हो सकता है। कोई वास्तविक साक्ष्य नहीं हो सकता है, लेकिन यह विश्वास है कि किसी उत्पाद में बहुत अधिक संभावित लाभ है और बहुत अधिक संभावित जोखिम नहीं है, और यह इस "वैधानिक आवश्यकता" को पूरा करेगा।
- कोई विकल्प नहीं
एफडीए द्वारा ईयूए जारी करने के लिए, बीमारी या स्थिति के निदान, रोकथाम या उपचार के लिए उम्मीदवार उत्पाद का कोई पर्याप्त, अनुमोदित और उपलब्ध विकल्प नहीं होना चाहिए। यदि आपातकालीन आवश्यकता को पूरी तरह से पूरा करने के लिए अनुमोदित विकल्प की अपर्याप्त आपूर्ति हो तो संभावित वैकल्पिक उत्पाद को "अनुपलब्ध" माना जा सकता है।
कानूनी प्रश्न: आइवरमेक्टिन और हाइड्रॉक्सीक्लोरोक्वीन जैसे वैकल्पिक कोविड-19 उपचारों की गंभीर और संभावित आपराधिक निंदा/गैर-कानूनी ठहराने के अलावा, किस बिंदु पर "कोविड-19 को रोकने" के लिए एक अनुमोदित विकल्प था (केवल एमआरएनए टीके ही खरीदने के लिए खरीदे गए थे) ) - उदाहरण के लिए, पैक्सलोविड - जो एमआरएनए टीकों के लिए ईयूए को अब वैध नहीं बना देगा?
यहां बताया गया है कि ये सभी "वैधानिक मानदंड" वास्तविक रूप से कैसे संतुष्ट थे बायोएनटेक/फाइजर कोविड एमआरएनए टीकों के लिए आपातकालीन उपयोग प्राधिकरण:
मैंने निष्कर्ष निकाला है कि प्राधिकरण के दायरे (धारा II) में वर्णित अनुसार प्रशासित होने पर सीओवीआईडी -19 की रोकथाम के लिए फाइजर-बायोएनटेक सीओवीआईडी‑19 वैक्सीन का आपातकालीन उपयोग धारा 564(सी) के तहत प्राधिकरण जारी करने के मानदंडों को पूरा करता है। अधिनियम, क्योंकि:
- SARS-CoV-2 इस वायरस से संक्रमित मनुष्यों में गंभीर श्वसन संबंधी बीमारी सहित गंभीर या जीवन-घातक बीमारी या स्थिति पैदा कर सकता है;
- FDA के पास उपलब्ध वैज्ञानिक साक्ष्यों की समग्रता के आधार पर, यह विश्वास करना उचित है कि Pfizer-BioNTech COVID‑19 वैक्सीन COVID-19 को रोकने में प्रभावी हो सकता है, और यह कि, जब इस प्राधिकरण में वर्णित शर्तों के तहत उपयोग किया जाता है, तो फाइजर-बायोएनटेक COVID‑19 वैक्सीन के ज्ञात और संभावित लाभ जब इसका उपयोग COVID-19 को रोकने के लिए किया गया इसके ज्ञात और संभावित जोखिमों से अधिक; और
- Pfizer-BioNTech COVID‑19 वैक्सीन के आपातकालीन उपयोग के लिए कोई पर्याप्त, अनुमोदित और उपलब्ध विकल्प नहीं है COVID-19 को रोकने के लिए.
[बोल्डफेस जोड़ा गया]
ध्यान दें: एकमात्र संदर्भ जिसमें एफडीए ने टीके के संभावित लाभों और जोखिमों को तौला, और जिसमें एफडीए ने निर्धारित किया कि यह "प्रभावी हो सकता है" था कोविड-19 को रोकने में.
इस पर कोई विचार नहीं किया गया है, वास्तविक या संभावित लाभ का कोई सबूत नहीं है, और इस बात का कोई निर्धारण नहीं है कि टीके के लिए कुछ और करने की कोई संभावित प्रभावशीलता है, जिसमें शामिल हैं: गंभीर बीमारी के जोखिम को कम करना, अस्पताल में भर्ती होने के जोखिम को कम करना, मृत्यु के जोखिम को कम करना। , वास्तव में या संभावित रूप से कोविड-19 से संबंधित किसी भी स्थिति के जोखिम को कम करना।
इसलिए, किसी भी दावे की वैधता पर उचित रूप से सवाल उठाया जा सकता है कि टीका "कोविड-19 को रोकने के लिए उपयोग किए जाने पर" के अलावा किसी अन्य संदर्भ में "सुरक्षित और प्रभावी" है - जिसके बारे में टीकों को उनके लागू होने के तुरंत बाद ऐसा नहीं करने के लिए जाना जाता था। परिचय कराया.
यदि लोगों को बताया जाता कि बायोएनटेक/फाइजर एमआरएनए टीके कोविड-19 को रोकने के अलावा किसी अन्य चीज के लिए "सुरक्षित और प्रभावी" हैं, और यदि उन्हें कोविड-19 को रोकने के अलावा किसी अन्य चीज के लिए टीका लेने में विफलता के लिए किसी भी परिणाम की धमकी दी गई थी, तो क्या वे ऐसा कर सकते थे? क्या उनके पास कोई वैध तर्क है कि उन्हें धोखाधड़ी वाले दावों के तहत एक अस्वीकृत उत्पाद लेने के लिए अवैध रूप से मजबूर किया गया था?
अस्वीकृत उत्पादों के लिए ईयूए के लिए तृतीय-स्तरीय आवश्यकताएँ
एक बार जब हमारे पास ईयूए-विशिष्ट आपातकालीन घोषणा हो जाती है, और एक बार एफडीए घोषणा कर देता है कि उत्पाद प्रभावी हो सकता है और जो भी साक्ष्य उपलब्ध है (शून्य से अनंत तक) यह दर्शाता है कि इसके लाभ इसके जोखिमों से अधिक हैं (जैसा कि एफडीए जो भी सोचता है उससे निर्धारित होता है) हो), गैर-सुरक्षा, गैर-प्रभावकारिता संबंधी विनियमन की एक और परत है।
यहां बताया गया है कि कैसे ए ईयूए पर 2018 कांग्रेसनल रिसर्च सर्विस रिपोर्ट यह समझाता है:
एफएफडीसीए §564 एफडीए को ईयूए में कुछ आवश्यक शर्तें लागू करने का निर्देश देता है और जहां उपयुक्त हो, अतिरिक्त विवेकाधीन शर्तों की अनुमति देता है। आवश्यक शर्तें इस बात पर निर्भर करती हैं कि ईयूए किसी अस्वीकृत उत्पाद के लिए है या किसी अनुमोदित उत्पाद के अस्वीकृत उपयोग के लिए है। किसी अस्वीकृत उत्पाद के लिए, उपयोग की शर्तें यह होनी चाहिए:
(1) सुनिश्चित करें कि उत्पाद का प्रबंधन करने वाले स्वास्थ्य देखभाल पेशेवरों को आवश्यक जानकारी प्राप्त हो;
(2) सुनिश्चित करें कि जिन व्यक्तियों को उत्पाद प्रशासित किया गया है उन्हें आवश्यक जानकारी प्राप्त हो;
(3) उत्पाद से जुड़ी प्रतिकूल घटनाओं की निगरानी और रिपोर्टिंग के लिए प्रावधान करना; और
(4) निर्माता द्वारा रिकॉर्ड रखने और रिपोर्टिंग की व्यवस्था करना।
कानूनी प्रश्न: वास्तव में "आवश्यक जानकारी" क्या है? हम जानते हैं कि लोगों को सूचित किया गया था कि टीकों को आपातकालीन उपयोग प्राधिकरण दिया गया था। लेकिन क्या उन्हें बताया गया कि इसका मतलब अन्य चिकित्सा उत्पादों पर "सुरक्षित और प्रभावी" दावों के लिए आवश्यक "साक्ष्य का निम्न स्तर" है? क्या उन्हें सूचित किया गया था कि "सुरक्षित और प्रभावी" के विभिन्न स्तर इस पर निर्भर करते हैं कि किसी उत्पाद के पास ईयूए है या किसी अन्य प्रकार का प्राधिकरण है?
ध्यान दें: कानून के अनुसार प्रतिकूल घटनाओं की निगरानी और रिपोर्ट करने का एक तरीका होना आवश्यक है। हालाँकि, इसमें यह नहीं बताया गया है कि निगरानी कौन करता है, रिपोर्टिंग के लिए मानक क्या हैं और रिपोर्ट के आधार पर कार्रवाई करने की सीमा क्या है।
ईयूए हर अन्य दवा/वैक्सीन अनुमोदन मार्ग की तुलना में
शोधकर्ता/लेखक के रूप में साशा लातिपोवा ने बताया है, कई लोग ईयूए से भ्रमित थे, क्योंकि यह काफी हद तक ईएयू जैसा लगता है, जिसका मतलब है "विस्तारित पहुंच उपयोग।" यह चिकित्सा उत्पादों को दिया जाने वाला एक प्रकार का प्राधिकरण है जब रोगियों के एक विशेष समूह (उदाहरण के लिए, स्टेज IV कैंसर रोगी जिनकी जीवन प्रत्याशा महीनों में मापी जाती है) को तत्काल आवश्यकता होती है, जो पहुंच के बदले में प्रतिकूल घटनाओं और यहां तक कि मृत्यु का जोखिम उठाने को तैयार होते हैं। एक प्रायोगिक उपचार के लिए.
आपातकालीन उपयोग प्राधिकरण किसी भी तरह से विस्तारित पहुंच उपयोग से संबंधित नहीं है, न ही इसका कोई समानता है।
चिकित्सा उत्पादों को अधिकृत करने के विभिन्न कानूनी रास्ते कानूनी शोधकर्ता द्वारा हाइलाइट की गई तालिका में बड़े करीने से प्रस्तुत किए गए हैं कैथरीन वाट. तालिका FDA-CDC संयुक्त शिक्षण सत्र के लिए 2020 प्रस्तुति का हिस्सा है: चिकित्सा प्रतिउपायों के उपयोग पर विनियामक अद्यतन.
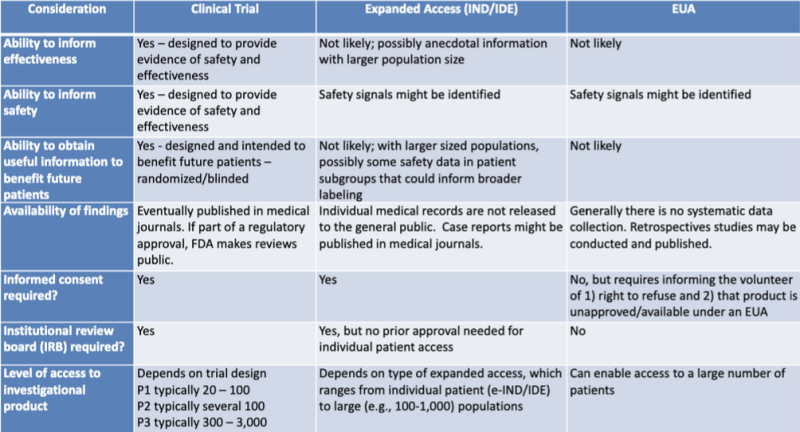
यह तालिका बहुत स्पष्ट रूप से दिखाती है कि ईयूए प्रक्रिया उत्पाद प्रभावशीलता के बारे में जानकारी प्रदान करने की संभावना नहीं है, इसे सुरक्षा के साक्ष्य प्रदान करने के लिए डिज़ाइन नहीं किया गया है, भविष्य के रोगियों को लाभ पहुंचाने के लिए उपयोगी जानकारी प्रदान करने की संभावना नहीं है, इसमें कोई व्यवस्थित डेटा संग्रह शामिल नहीं है, किसी पूर्वव्यापी अध्ययन की आवश्यकता नहीं है, कोई सूचित सहमति नहीं, और कोई संस्थागत समीक्षा बोर्ड नहीं।
इसके अलावा, ए में 2009 राष्ट्रीय शैक्षणिक प्रकाशन का इंस्टीट्यूट ऑफ मेडिसिन, वॉट द्वारा भी हाइलाइट किया गया, जिसका शीर्षक है "मेडिकल काउंटरमेजर्स: डिस्पेंसिंग इमरजेंसी यूज़ ऑथराइजेशन एंड द पोस्टल मॉडल - वर्कशॉप सारांश" हमें यह कथन पी पर मिलता है। 28:
यह पहचानना महत्वपूर्ण है कि ईयूए विकास पथ का हिस्सा नहीं है; यह एक पूरी तरह से अलग इकाई है जिसका उपयोग केवल आपातकालीन स्थितियों के दौरान किया जाता है और यह दवा अनुमोदन प्रक्रिया का हिस्सा नहीं है।
क्या इसका मतलब यह है कि ईयूए पर आधारित कोविड-19 प्रतिकार उपायों की मंजूरी अवैध थी? क्या इसका मतलब यह है कि यह दावा करने का कोई कानूनी तरीका नहीं है कि EUA उत्पाद "सुरक्षित और प्रभावी" है क्योंकि यह दवा अनुमोदन प्रक्रिया का हिस्सा नहीं है?
निष्कर्ष
इस लेख और पिछले लेख में दी गई सारी जानकारी से यह बिल्कुल स्पष्ट है भाग 1, कि बायोएनटैक/फाइजर कोविड एमआरएनए टीके जैविक युद्ध/आतंकवाद से जुड़ी आपातकालीन स्थितियों के लिए आरक्षित सैन्य कानूनों के तहत विकसित, निर्मित और अधिकृत किए गए थे, न कि पूरी नागरिक आबादी को प्रभावित करने वाली प्राकृतिक रूप से होने वाली बीमारियों के लिए।
इसलिए, जब किसी उत्पाद को संपूर्ण नागरिक आबादी के लिए "सुरक्षित और प्रभावी" माना जाता है तो हम नियमों और निरीक्षण का पालन करने की उम्मीद करते हैं, जो कानूनी रूप से आवश्यक नहीं था।
क्या इस विश्लेषण का उपयोग उन सरकारी अधिकारियों द्वारा "सुरक्षित और प्रभावी" दावे की वैधता को चुनौती देने के लिए किया जा सकता है जो जानते थे कि ईयूए में क्या शामिल है? क्या अन्य कानूनी अड़चनें हैं?
मुझे ऐसी ही उम्मीद है।
महत्वपूर्ण बात यह है कि अब तक लाए गए कोविड एमआरएनए टीकों की कानूनी चुनौतियों में, इस पर कोई निर्णय नहीं लिया गया है (जिसकी मुझे जानकारी है) कि क्या ओटीए और ईयूए जैसे सैन्य कानून को नागरिक स्थितियों पर लागू किया जा सकता है। हालाँकि, जिला न्यायालय के न्यायाधीश माइकल ट्रंकेल का एक बयान आया है व्हिसलब्लोअर का मामला ख़ारिज ब्रुक जैक्सन बनाम वेंटाविया और फाइजर, इसे ध्यान में रखना महत्वपूर्ण है।
यहां न्यायाधीश ने स्वीकार किया कि बायोएनटेक/फाइजर एमआरएनए टीकों के लिए समझौता एक सैन्य ओटीए था, लेकिन उन्होंने गैर-सैन्य परिस्थितियों (प्राकृतिक रूप से होने वाली बीमारी, 100 मिलियन खुराक ज्यादातर सैन्य उपयोग के लिए नहीं) के लिए इसकी प्रयोज्यता पर शासन करने से इनकार कर दिया, जिसके तहत यह जारी किया गया था:
तथ्य यह है कि सैन्य कर्मियों और नागरिकों दोनों को टीका प्राप्त हुआ, यह इंगित नहीं करता है कि टीका प्राप्त करना सेना के मिशन की प्रभावशीलता को बढ़ाने के लिए अप्रासंगिक था। इससे भी महत्वपूर्ण बात यह है कि सुश्री जैक्सन वास्तव में इस न्यायालय से फाइजर का टीका खरीदने के लिए अन्य लेनदेन प्राधिकरण का प्रयोग करने के डीओडी के फैसले को खारिज करने के लिए कह रही हैं। लेकिन जैसा कि संयुक्त राज्य अमेरिका के सुप्रीम कोर्ट ने लंबे समय से जोर दिया है, "सैन्य बल की संरचना, प्रशिक्षण, उपकरण और नियंत्रण के रूप में जटिल सूक्ष्म और पेशेवर निर्णय अनिवार्य रूप से पेशेवर सैन्य निर्णय हैं।" गिलिगन बनाम मॉर्गन, 413 यू.एस. 1, 10 (1973) इस प्रकार, "सरकारी गतिविधि के ऐसे क्षेत्र की कल्पना करना कठिन है जिसमें अदालतों की क्षमता कम हो।" पहचान। यह न्यायालय राष्ट्रीय आपातकाल के दौरान मिशन की प्रभावशीलता से संबंधित DoD के निर्णयों पर वीटो नहीं लगाएगा।
यह कई कानूनी बाधाओं में से एक है जो अंततः कोविड-19 आपातकाल के दौरान अनुमोदित सभी एमआरएनए उत्पादों और बाद के किसी भी एमआरएनए उत्पादों को अवैध घोषित करने की लड़ाई में बनी हुई है, जिनकी मंजूरी कोविड-19 अनुमोदन प्रक्रिया पर आधारित थी।
ए के तहत प्रकाशित क्रिएटिव कॉमन्स एट्रिब्यूशन 4.0 इंटरनेशनल लाइसेंस
पुनर्मुद्रण के लिए, कृपया कैनोनिकल लिंक को मूल पर वापस सेट करें ब्राउनस्टोन संस्थान आलेख एवं लेखक.









