कोविड महामारी के दौरान, अमेरिकी सरकार ने लाखों लोगों की सुरक्षा, निदान और उपचार के उद्देश्य से लगभग 400 उत्पादों पर अरबों डॉलर खर्च किए - सभी "ईयूए" या "आपातकालीन उपयोग प्राधिकरण" लेबल के साथ।
लेकिन EUA का वास्तव में क्या मतलब है?
इससे पहले कि हम उस प्रश्न का उत्तर दें, और यह समझने के तरीके से कि चिकित्सा उत्पादों को अधिकृत या अनुमोदित करने के लिए ईयूए अन्य मार्गों के संबंध में कहां खड़ा है, यह देखना उपयोगी है EUA क्या नहीं है:
ईयूए क्लिनिकल परीक्षण से गुजरने वाले प्रायोगिक उत्पाद के लिए एक पदनाम नहीं है
यदि हम ईयूए के बारे में केवल एक बात समझते हैं तो वह यह होनी चाहिए: ईयूए एफडीए नियमों या अन्य कानूनी आवश्यकताओं द्वारा शासित नैदानिक परीक्षण से गुजरने वाले उत्पाद पर लागू नहीं होता है।
ईयूए भी विस्तारित एक्सेस उपयोग (ईएयू) के समान नहीं है, जिसे अक्सर "दयालु उपयोग" पहुंच कहा जाता है, जो गंभीर, लाइलाज बीमारियों वाले रोगियों को पूरी तरह से अनुमोदित होने से पहले प्रयोगात्मक उत्पादों तक पहुंच प्रदान करने पर लागू होता है।
यह तालिका एक से एफडीए-सीडीसी 2020 प्रस्तुति नैदानिक परीक्षणों से गुजरने वाले उत्पादों, विस्तारित "दयालु" पहुंच के माध्यम से रोगियों को दिए गए उत्पादों और ईयूए के माध्यम से अधिकृत उत्पादों के बीच अंतर का सारांश दिया गया है:
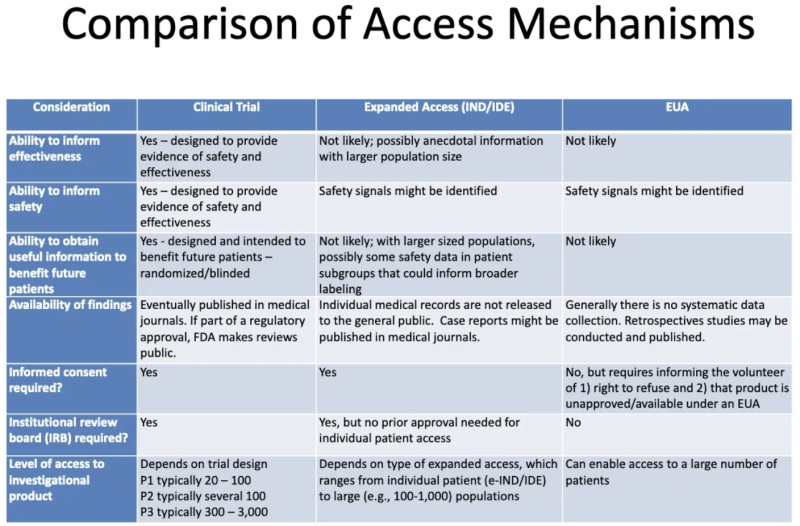
यह तालिका हमें ईयूए के बारे में क्या बताती है:
- ईयूए देने की प्रक्रिया से किसी उत्पाद की प्रभावशीलता के बारे में कोई जानकारी उत्पन्न होने की संभावना नहीं है।
- EUA देने की प्रक्रिया सुरक्षा या प्रभावशीलता का प्रमाण प्रदान करने के लिए डिज़ाइन नहीं की गई है, लेकिन सुरक्षा संकेतों की पहचान की जा सकती है।
- यह संभावना नहीं है कि एक बार जब किसी उत्पाद को ईयूए प्रदान कर दिया जाता है और कुछ रोगियों को प्रशासित किया जाता है, तो भविष्य के रोगियों को लाभ पहुंचाने के लिए कोई उपयोगी जानकारी प्राप्त की जाएगी।
- ईयूए के साथ प्रभावशीलता या सुरक्षा पर कोई व्यवस्थित डेटा संग्रह नहीं है, और नियामक अनुमोदन प्रक्रिया के हिस्से के रूप में चिकित्सा पत्रिकाओं में कोई डेटा प्रकाशित नहीं किया जाता है।
- किसी सूचित सहमति की आवश्यकता नहीं है, लेकिन जो मरीज़ उत्पाद लेने के लिए "स्वयंसेवक" हैं, उन्हें बताया जाना चाहिए कि वे मना कर सकते हैं और उत्पाद ईयूए के तहत अस्वीकृत/उपलब्ध है।
- किसी संस्थागत समीक्षा बोर्ड (आईआरबी) की आवश्यकता नहीं है। [आईआरबी एक बोर्ड है जिसका उद्देश्य नैदानिक परीक्षणों में मानव विषयों की भलाई की रक्षा करना है]
आगे यह स्पष्ट करने के लिए कि ईयूए किसी भी सामान्य अनुमोदन प्रक्रिया से कितना अलग है 2009 राष्ट्रीय अकादमियों के प्रकाशन संस्थान के चिकित्सा संस्थान, हमें यह कथन मिलता है:
यह पहचानना महत्वपूर्ण है कि ईयूए विकास पथ का हिस्सा नहीं है; यह एक पूरी तरह से अलग इकाई है जिसका उपयोग केवल आपातकालीन स्थितियों के दौरान किया जाता है और यह दवा अनुमोदन प्रक्रिया का हिस्सा नहीं है। (पृ. 28)
संक्षेप करने के लिए:
किसी उत्पाद को ईयूए देने की प्रक्रिया से सुरक्षा या प्रभावशीलता का कोई सबूत मिलने की संभावना नहीं है। एक बार जब किसी उत्पाद को EUA प्रदान कर दिया जाता है और रोगियों को प्रशासित किया जाता है, तो यह संभावना नहीं है कि भविष्य के रोगियों को लाभ पहुंचाने के लिए कोई उपयोगी जानकारी प्राप्त की जाएगी, क्योंकि प्रभावशीलता या सुरक्षा पर कोई व्यवस्थित डेटा संग्रह नहीं है।
सीडीसी/एफडीए और आईएमएनए की इस स्पष्ट जानकारी के आधार पर, यह निष्कर्ष निकालना उचित होगा कि आपातकालीन उपयोग प्राधिकरण एक ऐसी प्रक्रिया है जिसे बहुत विवेकपूर्ण तरीके से और केवल गंभीर आपात स्थितियों के मामलों में ही लागू किया जाना चाहिए।
अब आइए देखें कि ईयूए को कानूनी तौर पर किस प्रकार की आपातकालीन स्थितियों से निपटने के लिए डिज़ाइन किया गया है।
EAU WMD आपात स्थितियों के लिए है
ऊपर वर्णित ईयूए "एक्सेस मैकेनिज्म" की अनुमति देने वाले कानून सामूहिक विनाश के हथियारों (डब्ल्यूएमडी) से जुड़े अत्यधिक, तत्काल आपात स्थितियों के मामलों के लिए तैयार किए गए थे, जिन्हें सीबीआरएन (रासायनिक, जैविक, रेडियोलॉजिकल, परमाणु) एजेंटों के रूप में भी जाना जाता है।
खाद्य एवं औषधि प्रशासन इस प्रकार है (एफडीए) अपनी ईयूए शक्तियों का वर्णन करता है:
FD&C अधिनियम की धारा 564 (21 यू.एस.सी. 360बीबीबी-3) एफडीए को जैविक, रासायनिक, परमाणु और रेडियोलॉजिकल एजेंटों के खिलाफ सार्वजनिक स्वास्थ्य सुरक्षा को मजबूत करने की अनुमति देता है।
इस EUA प्राधिकरण के साथ, FDA यह सुनिश्चित करने में मदद कर सकता है कि जैविक, रासायनिक, परमाणु या रेडियोलॉजिकल एजेंटों के कारण होने वाली गंभीर या जीवन-घातक बीमारियों या स्थितियों के निदान, उपचार या रोकथाम के लिए आपातकालीन स्थितियों में चिकित्सा प्रति-उपायों का उपयोग किया जा सकता है, जब पर्याप्त, अनुमोदित नहीं होते हैं , और उपलब्ध विकल्प (अन्य मानदंडों के बीच)।
ये ईयूए शक्तियां सीबीआरएन एजेंटों द्वारा हमलों की तैयारी से संबंधित बहुत विशिष्ट परिस्थितियों में 2004 में प्रदान की गई थीं।
यथा व्याख्यायित हार्वर्ड लॉ के स्वास्थ्य विधेयक में,
अंततः, यह आतंक के विरुद्ध युद्ध ही था जो आपातकालीन उपयोग प्राधिकरण को जन्म देगा। 11 सितंबर 2001 की घटनाओं और उसके बाद एंथ्रेक्स मेल हमलों के बाद, कांग्रेस ने अधिनियम बनाया 2004 का प्रोजेक्ट बायोशील्ड अधिनियम.
RSI रिकॉर्ड इंगित करता है कि कांग्रेस का ध्यान विशेष रूप से जैव-आतंकवाद के खतरे पर था, न कि प्राकृतिक रूप से उत्पन्न होने वाली महामारी की तैयारी पर।
WMD हमले से जुड़ी ऐसी संकीर्ण प्रकार की अत्यधिक आपातकालीन स्थिति को देखते हुए, यह समझ में आता है कि EUA "पहुंच तंत्र" को किसी भी विनिर्माण या नैदानिक परीक्षण मानकों के लिए बहुत अधिक नियामक निरीक्षण या पालन की आवश्यकता क्यों नहीं है।
तो EUA पहुंच तंत्र को वास्तव में क्या चाहिए?
आपातकालीन उपयोग प्राधिकरण (ईयूए) के लिए 3 चरण
किसी चिकित्सा उत्पाद को EUA प्रदान करने के लिए तीन चीजें होनी चाहिए:
- होमलैंड सिक्योरिटी सचिव, रक्षा सचिव, या स्वास्थ्य और मानव सेवा सचिव को यह निर्धारित करने की आवश्यकता है कि कोई आपातकालीन स्थिति है जिसमें सीबीआरएन एजेंट के साथ हमला या हमले का खतरा या ऐसे एजेंट के कारण होने वाली कोई बीमारी शामिल है।
- एफडीए को यह सुनिश्चित करना होगा कि ईयूए जारी करते समय वह चार "वैधानिक मानदंडों" को पूरा करे।
- FDA को EUA में "कुछ आवश्यक शर्तें लगानी होंगी"।
ईयूए चरण 1: सीबीआरएन आपातकाल की घोषणा
ईयूए के लिए आपातकालीन घोषणा राष्ट्रपति, एचएचएस सचिव या किसी अन्य द्वारा जारी की जा सकने वाली किसी भी अन्य आपातकालीन घोषणा से अलग और असंबंधित है। इसे विशेष रूप से ईयूए को सक्रिय करने के उद्देश्य से जारी किया जाना चाहिए और इसे किसी अन्य आपातकालीन घोषणा से स्वतंत्र रूप से समाप्त या बढ़ाया जा सकता है।
यहाँ क्या है EUA कानून कहता है EUA "पहुंच तंत्र" को सक्रिय करने के लिए चार संभावित परिदृश्य हैं:
- होमलैंड सिक्योरिटी के सचिव द्वारा एक दृढ़ संकल्प कि घरेलू आपातकाल है, या घरेलू आपातकाल की एक महत्वपूर्ण संभावना है, जिसमें जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंटों के साथ हमले का खतरा बढ़ गया है;
- रक्षा सचिव द्वारा एक दृढ़ संकल्प कि एक सैन्य आपातकाल है, या एक सैन्य आपातकाल की महत्वपूर्ण संभावना है, जिसमें एक बढ़ा हुआ जोखिम शामिल है यूनाइटेड राज्य सैन्य बल, जिसमें हमले के शीर्षक 10 या शीर्षक 50 के अधिकार के तहत काम करने वाले कर्मी शामिल हैं-
- एक जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंट; या
- एक एजेंट या एजेंट जो युनाइटेड के लिए आसन्न जीवन-घातक और विशिष्ट जोखिम पैदा कर सकता है, या अन्यथा उससे जुड़ा हुआ है राज्य सैनिक बल;
- द्वारा एक संकल्प सचिव [स्वास्थ्य और मानव सेवा] कि एक सार्वजनिक स्वास्थ्य आपातकाल है, या सार्वजनिक स्वास्थ्य आपातकाल की एक महत्वपूर्ण संभावना है, जो राष्ट्रीय सुरक्षा या स्वास्थ्य और सुरक्षा को प्रभावित करती है, या प्रभावित करने की महत्वपूर्ण क्षमता रखती है। यूनाइटेड राज्य विदेश में रहने वाले नागरिक, और इसमें कोई जैविक, रासायनिक, रेडियोलॉजिकल, या परमाणु एजेंट या एजेंट, या कोई बीमारी या स्थिति शामिल है जो ऐसे एजेंट या एजेंटों के लिए जिम्मेदार हो सकती है; या
- की धारा 319एफ-2 के अनुसार किसी भौतिक खतरे की पहचान सार्वजनिक स्वास्थ्य सेवा अधिनियम [42 यू.एस.सी. 247डी-6बी] राष्ट्रीय सुरक्षा या स्वास्थ्य और सुरक्षा को प्रभावित करने के लिए पर्याप्त है यूनाइटेड राज्य विदेश में रहने वाले नागरिक.
ईयूए चरण 2. वैधानिक मानदंडों को पूरा करना
एक बार सचिवों में से एक ने घोषणा की है कि एक आपात स्थिति है जो ईयूए की गारंटी देती है, तो चार और "वैधानिक मानदंड" हैं जिन्हें ईयूए जारी करने के लिए एफडीए को पूरा करना होगा। यहां बताया गया है कि FDA इन आवश्यकताओं को कैसे समझाता है:
- गंभीर या जीवन-घातक रोग या स्थिति
एफडीए द्वारा ईयूए जारी करने के लिए, एचएचएस सचिव की ईयूए घोषणा में उल्लिखित सीबीआरएन एजेंट गंभीर या जीवन-घातक बीमारी या स्थिति पैदा करने में सक्षम होना चाहिए।
- प्रभावशीलता का प्रमाण
जिन चिकित्सा उत्पादों पर ईयूए के लिए विचार किया जा सकता है, वे वे हैं जो एचएचएस सचिव की घोषणा में पहचाने गए सीबीआरएन एजेंटों के कारण होने वाली गंभीर या जीवन-घातक बीमारियों या स्थितियों को रोकने, निदान या इलाज करने के लिए "प्रभावी" हो सकते हैं। धारा 564(बी) के तहत आपातकाल या आपातकाल का खतरा।
ईयूए के लिए "प्रभावी हो सकता है" मानक "प्रभावीता" मानक की तुलना में निम्न स्तर के साक्ष्य प्रदान करता है जिसे एफडीए उत्पाद अनुमोदन के लिए उपयोग करता है। एफडीए जोखिम-लाभ विश्लेषण का उपयोग करके मामले-दर-मामले आधार पर संभावित ईयूए उत्पाद की संभावित प्रभावशीलता का आकलन करने का इरादा रखता है, जैसा कि नीचे बताया गया है।
[बोल्डफेस जोड़ा गया]
- जोखिम-लाभ विश्लेषण
किसी उत्पाद पर ईयूए के लिए विचार किया जा सकता है यदि आयुक्त यह निर्धारित करता है कि उत्पाद के ज्ञात और संभावित लाभ, जब पहचानी गई बीमारी या स्थिति के निदान, रोकथाम या उपचार के लिए उपयोग किए जाते हैं, तो उत्पाद के ज्ञात और संभावित जोखिमों से अधिक होते हैं।
यह निर्धारित करने में कि क्या उत्पाद के ज्ञात और संभावित लाभ ज्ञात और संभावित जोखिमों से अधिक हैं, एफ.डी.ए देखने का इरादा है समग्र जोखिम-लाभ निर्धारण करने के लिए वैज्ञानिक प्रमाणों की समग्रता पर। ऐसे सबूत, जो उत्पन्न हो सकता है विभिन्न स्रोतों से, हो सकता है कि शामिल हो (लेकिन यह यहीं तक सीमित नहीं है): घरेलू और विदेशी नैदानिक परीक्षणों के परिणाम, पशु मॉडल से इन विवो प्रभावकारिता डेटा, और इन विट्रो डेटा, एफडीए विचार के लिए उपलब्ध है. एफडीए इसकी गुणवत्ता और मात्रा का भी आकलन करेगा उपलब्ध साक्ष्य, वैज्ञानिक ज्ञान की वर्तमान स्थिति को देखते हुए।
[बोल्डफेस जोड़ा गया]
- कोई विकल्प नहीं
एफडीए द्वारा ईयूए जारी करने के लिए, बीमारी या स्थिति के निदान, रोकथाम या उपचार के लिए उम्मीदवार उत्पाद का कोई पर्याप्त, अनुमोदित और उपलब्ध विकल्प नहीं होना चाहिए। यदि आपातकालीन आवश्यकता को पूरी तरह से पूरा करने के लिए अनुमोदित विकल्प की अपर्याप्त आपूर्ति हो तो संभावित वैकल्पिक उत्पाद को "अनुपलब्ध" माना जा सकता है।
ईयूए चरण 3. आवश्यक शर्तें लागू करना
एक बार जब हमारे पास ईयूए-विशिष्ट आपातकालीन घोषणा होती है, और एक बार एफडीए यह निर्धारित करता है कि उत्पाद प्रभावी हो सकता है और जो भी सबूत उपलब्ध है वह दिखाता है कि इसके लाभ इसके जोखिमों से अधिक हैं, संबंधित विनियमन की एक और परत होती है।
यहां बताया गया है कि कैसे ए ईयूए पर 2018 कांग्रेसनल रिसर्च सर्विस रिपोर्ट यह समझाता है:
एफएफडीसीए §564 एफडीए को ईयूए में कुछ आवश्यक शर्तें लागू करने का निर्देश देता है और जहां उपयुक्त हो, अतिरिक्त विवेकाधीन शर्तों की अनुमति देता है। आवश्यक शर्तें इस बात पर निर्भर करती हैं कि ईयूए किसी अस्वीकृत उत्पाद के लिए है या किसी अनुमोदित उत्पाद के अस्वीकृत उपयोग के लिए है। किसी अस्वीकृत उत्पाद के लिए, उपयोग की शर्तें यह होनी चाहिए:
(1) सुनिश्चित करें कि उत्पाद का प्रबंधन करने वाले स्वास्थ्य देखभाल पेशेवरों को आवश्यक जानकारी प्राप्त हो;
(2) सुनिश्चित करें कि जिन व्यक्तियों को उत्पाद प्रशासित किया गया है उन्हें आवश्यक जानकारी प्राप्त हो;
(3) उत्पाद से जुड़ी प्रतिकूल घटनाओं की निगरानी और रिपोर्टिंग के लिए प्रावधान करना; और
(4) निर्माता द्वारा रिकॉर्डकीपिंग और रिपोर्टिंग प्रदान करना।
निष्कर्ष
जैसा कि इस लेख में बताया गया है, एफडीए/सीडीसी स्पष्ट रूप से मानता है कि आपातकालीन उपयोग प्राधिकरण (ईयूए) देने की प्रक्रिया से किसी उत्पाद की प्रभावशीलता या सुरक्षा के बारे में कोई जानकारी उत्पन्न होने की संभावना नहीं है। जब हम ईयूए को नियंत्रित करने वाले कानून के पत्र को देखते हैं, तो हम देखते हैं कि यह वास्तव में एक सही मूल्यांकन है।
ईयूए कानून कोई कानूनी या नियामक मानक लागू नहीं करता है जो यह निर्धारित कर सके कि कोई उत्पाद सुरक्षित या प्रभावी है या नहीं। एकमात्र मानक यह है कि क्या एफडीए का मानना है कि उत्पाद प्रभावी हो सकता है और इसके ज्ञात लाभ इसके ज्ञात नुकसान से अधिक हैं। यदि कोई ज्ञात हानि या ज्ञात लाभ नहीं हैं, क्योंकि उत्पाद कभी भी दवा अनुमोदन प्रक्रिया से नहीं गुजरा है, तो एफडीए यह निर्धारण करने के लिए जो भी जानकारी या मानक चुनता है उसका उपयोग कर सकता है।
इस सब से यह पता चलता है कि एक कंपनी जिसका उत्पाद ईयूए के लिए उम्मीदवार है, वह अपने द्वारा चुने गए किसी भी माध्यम से उत्पाद की सुरक्षा और/या प्रभावशीलता को प्रदर्शित करने का प्रयास कर सकती है। इस तरह के प्रयास का अस्तित्व (चाहे नैदानिक परीक्षण हो या अन्य डेटा-संग्रह तंत्र), और वह प्रयास कैसे किया जाता है, यह सब कंपनी पर निर्भर है। ईयूए कानून में कुछ भी इस पर लागू नहीं होता है कि कंपनी किसी भी अध्ययन या अन्य डेटा-संग्रह तंत्र को कैसे डिजाइन, संचालन या विश्लेषण करती है जिसे वह आगे बढ़ाने के लिए चुनती है।
कोविड उत्पादों पर लागू होने पर इसका अर्थ है:
- ईयूए प्राप्त करने के लिए कोविड उत्पादों के लिए नैदानिक परीक्षणों से कोई सुरक्षा या प्रभावकारिता डेटा की आवश्यकता नहीं थी।
- ईयूए प्रक्रिया में संदर्भित कोई भी नैदानिक परीक्षण बिना किसी कानूनी रूप से लागू नियामक मानकों के आयोजित किया गया था।
- जब हमें पता चलता है कि इन उत्पादों में प्रभावकारिता या सुरक्षा की कमी है, तो यह आश्चर्य की बात नहीं है। यह प्रक्रिया का अत्यधिक संभावित परिणाम है।
- ईयूए प्रक्रिया से ऐसा कोई डेटा नहीं है जिस पर उत्पाद की सुरक्षा या प्रभावकारिता के बारे में गैर-ईयूए निर्णयों को आधार बनाया जा सके। इसलिए उत्पाद के किसी भी गैर-ईयूए उपयोग के लिए शुरुआत से ही नियमित चिकित्सा उत्पादों के लिए कानूनी अनुमोदन प्रक्रिया से गुजरना होगा।
कोविड टीकों के लिए अनुमोदन प्रक्रिया के बारे में अधिक जानकारी यहाँ उत्पन्न करें.
लेखक से पुनर्प्रकाशित पदार्थ
ए के तहत प्रकाशित क्रिएटिव कॉमन्स एट्रिब्यूशन 4.0 इंटरनेशनल लाइसेंस
पुनर्मुद्रण के लिए, कृपया कैनोनिकल लिंक को मूल पर वापस सेट करें ब्राउनस्टोन संस्थान आलेख एवं लेखक.









